酸を強くしたり弱くしたりする要素は何だろうか。この答えを知るためには、まず酸の定義を確認する必要がある。電子を受け取る、または水素イオン(プロトン)を与える(解離する)化合物である。
そのため、酸の強さは水素イオンの解離度に依存する。つまり、溶液の中で酸が作り出す水素イオンの数が多いほど、その酸は強くなる。
地球上で最強の酸のリストを見る前に、知っておくべき用語とその定義を見てみよう。
酸解離定数(Ka):定量可能な水溶液中の酸の強さを表す。酸イオン化定数または酸定数とも言われる。pHは溶液の液性を表すが、この場合は溶液の酸性度であり、酸解離定数は溶液中の水素イオン[H+]または水素イオン[H3O+]の濃度を示す。
これに関連する酸性の指標pKaも重要である。pKaは一般的にKaの負の対数である。
pKa = -log10Ka
酸が強いほど、pKaの値は低くなる。
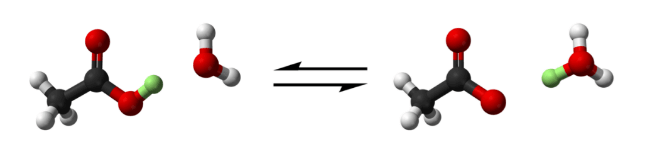
酢酸が水にプロトン(緑色)を与えることで、水素と酢酸イオンが作り出される(赤:酸素、白:水素、炭素:黒)。
ハメットの酸性度関数(Ho):pHは酸性度・塩基度を表す指標として広く使用されているが、超酸性のレベルでは硫酸や塩酸の100万倍の酸性度となるため使えない。
そこで超酸性の塩基度を測定するためにハメットの酸性度関数が使われるようになった。これはアメリカの物理化学者のルイス・プラック・ハメットが提唱した。
超酸:超酸とは、硫酸100%の酸度を超え、ハメットの酸性度関数が-12よりも低い酸のことである。より科学的な言葉でいうと、プロトン化能が純粋な硫酸よりも高い媒質と定義される。
8.硫酸
紙上の硫酸
化学式:H2SO4
pKa値: -3
Ho値: 12
硫酸(ビトリオール)は改めて紹介する必要もないが、無色無臭で水と混ぜると激しい熱反応を起こす。硫酸は農業、廃水処理、石油精製など様々な産業において不可欠なものである。電池や洗剤にも使われる。
酸全体を学ぶ際にも硫酸は非常に重要である。硫酸は超酸や酸の酸性度レベルを比較する際に基準として用いられる。硫酸の生成方法はいくつかあるが、一般的に使われるのは接触法と湿式法である。
H2SO4は皮膚に直接触れるとかなりのダメージがある。また多くの金属に対して腐食性がある。酸化・脱水の特性が強いため、高濃度では腐食性・危険性がかなり高くなる化学物質である。
7.塩酸

化学式: HCl
pKa値: -5.9
硫酸と同じように、塩酸もラボや様々な産業で広く使われている重要な化学物質である。塩酸は西暦800年頃、イランの博学者ジャービル・イブン・ハイヤーンが発見した。
塩酸の方が硫酸よりも強いのになぜ硫酸が超酸の基準として使われているか不思議に思うかもしれないが、それは硫酸が二塩基酸であり、通常完全には分離しないからである。
硫酸からの硫酸イオンの解離度よりも、塩化物からの水素イオンの解離度の方が高いため、硫酸よりも塩酸の方が強い。
塩酸は主に重工業で使用されており、加工前の鉄や鋼のさび抜きに使われる。また、塩酸は有機(PVC(ポリ塩化ビニル)に使われる塩化ビニル)・無機化合物を生産する際の重要な成分でもある。
6.トリフル酸

トリフルオロメタンスルホン酸
化学式: CF3SO3H
pKa値: -14.7
トリフルオロメタンスルホン酸は、通常トリフル酸と呼ばれている。1954年にイギリスの化学者ロバート・ハッゼルディンによって合成・発見された。化学的・熱的安定性が優れている。硝酸や過塩素酸など他の強い酸は酸化しやすいが、トリフル酸は酸化しにくい。
トリフル酸はプロトン化・滴定(化学物質の定量分析法)で使用される。クロロスルホン酸や硫酸と違い、スルホン化しないため好んで使われることがある。
言うまでもなく、トリフル酸はかなり危険な物質である。皮膚に触れれば重症な火傷を負い、その後わずかに組織へのダメージも現れることがある。また、吸入すると肺水腫や痙攣、その他の重大な状態を引き起こすこともある。
5.フルオロスルホン酸
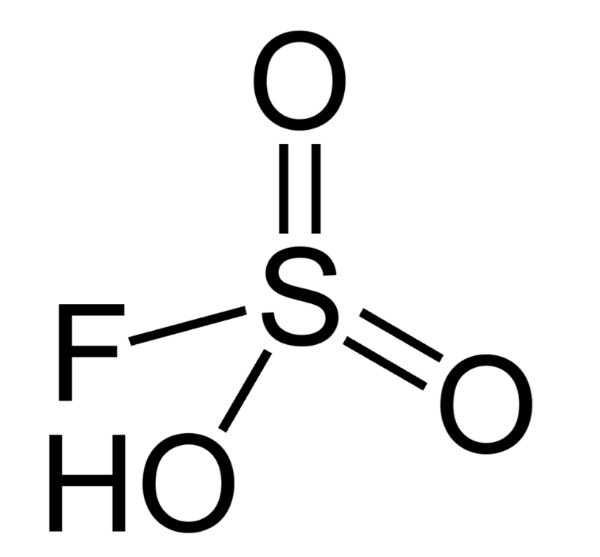
化学式: HSO3F
Ho値: -15.1
pKa値: -10
フルオロスルホン酸(正式名称はスルフロフルオリド酸)は今日入手可能な単一成分の酸の中では二番目に強力な酸である。見た目は黄色く、強力な腐食性・毒性を有する。HSO3Fは一般的にフッ化水素と三酸化硫黄を反応させることによって生成され、五フッ化アンチモンと混ぜると、「マジック酸」というさらに強力なプロトン化剤ができる。
フルオロスルホン酸は炭化水素(アルケンなど)のアルキル化やアルケンの異性化、ガラスエッチング(ガラスアート)に使われる。ラボに普通に置いてあるフッ素化剤である。
4.過塩素酸

過塩素酸60%
化学式: HClO4
pKa値: -10, -15.2
過塩素酸は知られている中では最も強力なブロンステッド−ローリー酸の一種であり、強力な酸化特性と腐食性が特徴である。昔から過塩素酸ナトリウムと塩酸(HCI)の処理によって生成される。塩化ナトリウムもこの方法で生成される。
NaClO4 + HCl → NaCl + HClO4
他の酸と違い、過塩素酸は加水分解されず、世界で最も規制が厳しい酸の一つである。1947年カリフォルニア州ロサンゼルスで、75%近い過塩素酸(体積)と25%の無水酢酸を含む化学物質の爆発により、150人がけがを負い、17人が死亡した。250以上もの建物・車両も破損している。
過塩素酸は爆発性を持つが、広く使用され特定の合成では好んで使われている。ロケット燃料に使われている過塩素酸アンモニウムの重要な成分でもある。
3.フッ素化カルボラン酸
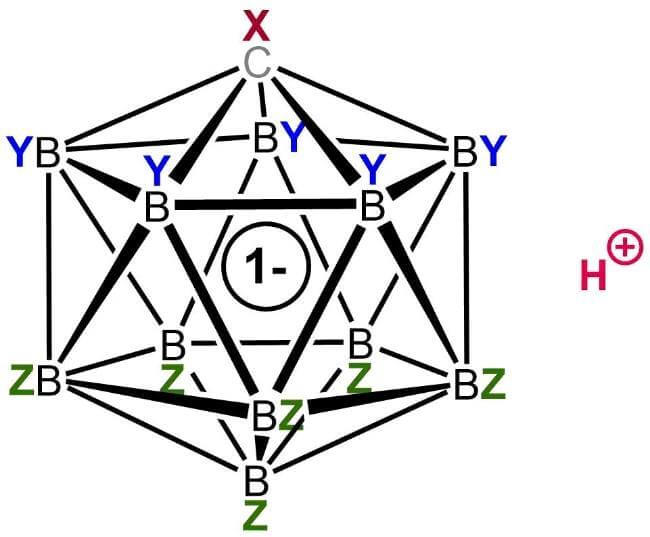
カルボラン酸の一般的な構造
化学式: H(CHB11F11)
Ho値: -18
pKa値: -20
カルボラン酸は知られている超酸の中で最も強力な酸の一つであり、中にはハメットの酸性度関数が-18を示すものもあると考えられている。実に100%硫酸の100万倍以上の強さである。
その一つがフッ素化カルボラン酸である。このような化学物質の存在自体が最初に報告されたのは2007年だったが、科学者たちがその性質の全容を解明できたのは2013年だった。フッ素化カルボラン酸の発見まで、最強のブロンステッド酸は塩素化カルボラン酸であった。
フッ素化カルボラン酸は二酸化炭素をプロトン化(水素イオンを移動)し、水素架橋カチオンを生成できる唯一の酸である。一方でマジック酸やHF-SbF5などの超酸で処理した場合は、二酸化炭素はあまりプロトン化されない。
2.マジック酸
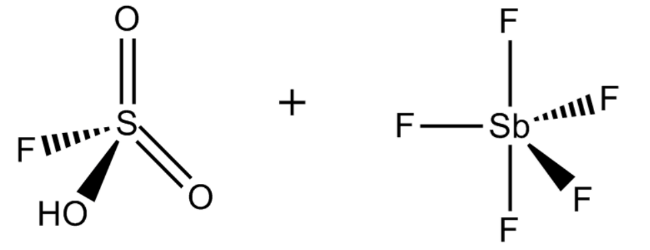
フルオロスルホン酸+五フッ化アンモチン(1:1)
化学式: FSO3H·SbF5
Ho値: -23
FSO3H·SbF5(一般的にはマジック酸と呼ばれている)は、フルオロスルホン酸と五フッ化アンモチンを1:1のモル比で混合することにより生成される。この超酸は1966年にオハイオ州のケース・ウェスタン・リザーブ大学ジョージ・オララボで開発された。
「マジック酸」というかなり変わった名前は、1966年にオララボが開催したイベントが由来である。そのイベントでは、ラボの研究員が炭化水素のプロトン化を実証するために、パラフィンキャンドルをマジック酸の上に乗せ、「魔法のように」溶解させてtert-ブチルカチオン溶液に変えた。
マジック酸の用途は、溶液中のカルボニウムイオンの安定化にほぼ限られる。例えば、飽和炭化水素の異性化促進やメタン、キセノン、ハロゲンといった弱塩基のプロトン化が可能である。
1.フルオロアンチモン酸
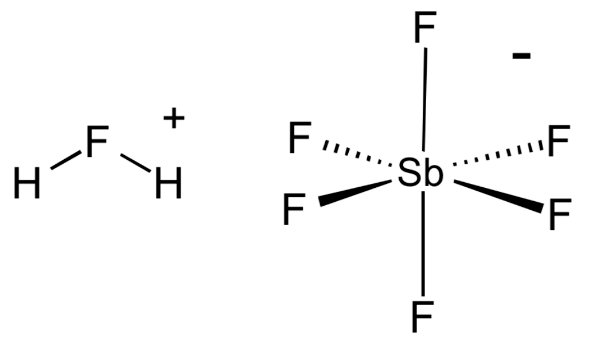
フルオロアンチモン酸の分子構造
化学式: H2FSbF6
Ho値: -15 (pure form), -28 (with >50 mol%)
フルオロアンチモン酸はハメットの酸性度関数による超酸の中でおそらく最も強力な酸である。マジック酸は通常、フッ化水素と五フッ化アンモチンを2:1の割合で混合することにより生成され、その過程で熱反応が起こる。
この超酸は化学工業や石油化学産業においてよく用いられる。例えば、ネオペンタンとイソブタン(両者ともアルカン)からそれぞれメタンとH2を分離するのにつかわれる。
当然のことながら、H2FSbF6は腐食性がかなり強く、水と接触すると激しい加水分解を起こす。ほとんどの超酸と一緒で、フルオロアンチモン酸もまたガラスを溶かしてしまうため、PTFE(ポリテトラフルオロエチレン)容器に保存する必要がある。
「世界で最強の酸」を検索して塩素化カルボラン酸にしろフッ素化カルボラン酸にしろ「カルボラン酸」にいきついた人が多いだろう。
厳密にいえば、地球上で最強の単一成分でできている酸と言えばカルボラン酸であり、過塩素酸やトリフル酸よりもずっと酸性度が高いと言って間違いではない。

























